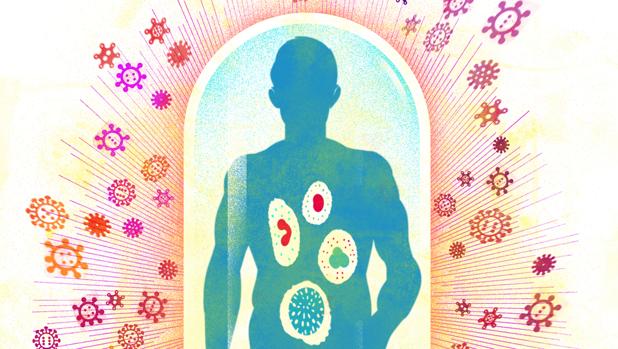
En medio de toda esta confusión de vacunas, tratamientos y medidas políticas, un ejército implacable y altamente profesional está luchando contra el SARS-CoV-2 lejos de la atención de los focos: se trata del sistema inmunitario. Mientras que el virus tiene genes de virulencia para replicarse y esquivar a las defensas, el sistema inmunitario tiene en su arsenal anticuerpos, células asesinas, barreras y hasta «armas químicas». Esta guerra es un duelo de titanes: tanto el virus como las defensas del organismo tienen a sus espaldas cientos de millones de años de evolución en los que han ido transformándose y perfeccionándose, con el paso de generaciones y más generaciones.
Sabemos que el sistema inmunitario ganará y que, con la ayuda de tratamientos o vacunas, o sin ella, se impondrá y la población seguirá adelante ( en este artículo hablamos sobre las grandes dudas que hay en relación con la inmunidad frente al coronavirus). Pero, ¿qué es, en pocas palabras, el sistema inmunitario? Alfredo Corell, Catedrático de Inmunología de la Universidad de Valladolid, lo define como «una red muy compleja de células y moléculas diferentes que están interconectadas entre sí».
De hecho, al igual que el sistema nervioso inerva todos los tejidos del organismo, el sistema inmunitario también extiende sus «redes» por doquier. Gracias a eso, puede hacer frente a todo tipo de amenazas: «Microorganismos patógenos, granos de polen o componentes de alimentos, cánceres o trasplantes», ha enumerado el Catedrático.
La primera línea de defensa: la piel y las mucosas
Como todo ejército profesional, el sistema inmunitario tiene entre sus tropas armas de diferentes niveles de especialización. Según Corell, sus herramientas básicas se pueden estratificar, artificialmente, en tres niveles. En primer lugar se encuentra el nivel cero, una muralla física «que separa el interior del exterior». Aquí entran la piel, el órgano más extenso del cuerpo humano, y metros y metros de mucosas, que tapizan el sistema respiratorio, el sistema digestivo, los ojos o el tracto genitourinario: «Éste es el nivel más básico de defensa, pero no por eso deja de ser muy importante», ha explicado.
Esta barrera es una auténtica empalizada: «Está formada por células que funcionan como ladrillos y que están unidas por conexiones muy fuertes, que constituyen una barrera física inexpugnable», en su opinión. A no ser, claro está, que se produzcan daños en los epitelios, como ocurre por ejemplo cuando nos cepillamos los dientes con fuerza y rompemos la barrera de la mucosa oral.
Aparte de eso, esta muralla también es una barrera química, «porque las células mucosas secretan sustancias que lo convierten en un ambiente hostil», según Corell. Así en la piel tenemos un pH ligeramente ácido, de 5,5, que dificulta la aparición de infecciones. Tampoco hay que olvidarse de la «ayuda» que brinda la microbiota, una batería de más de 500 tipos de hongos y bacterias que dificultan la proliferación de los microorganismos patógenos.
La segunda línea: la inmunidad innata
Pero si algo demuestra la historia es que ninguna muralla es inexpugnable. Por ello, justo «detrás» de este primer parapeto se encuentra la inmunidad innata o natural: «Ésta no cambia a lo largo de la vida y responde siempre igual sin importar de qué patógeno se trate o si es la primera o la segunda infección», ha comentado Alfredo Corell. Sería algo así como una policía de servicio 24 horas y dispuesta a responder ante cualquier amenaza rápidamente.
La inmunidad innata suele comenzar cuando las células infectadas producen unas moléculas, conocidas como interferones, que avisan a células vecinas para que paralicen la producción de proteínas, de forma que serán menos proclives a fabricar nuevos virus. Pero, aparte de eso, este nivel de defensa tiene un amplio arsenal a su alcance.
Forman parte de él los macrófagos, que fagocitan —engloban y digieren— células infectadas o patógenos; las células asesinas naturales, que «disparan» unas sustancias a células infectadas para matarlas; la supuración, un proceso por el que se produce un líquido que contiene células muertas y linfocitos alrededor de las células infectadas; o el complemento, un arsenal de moléculas que funciona como una red de mensajería y aviso para alertar a las defensas y que es esencial para acabar con las bacterias patógenas.
Muchas de estas células y sustancias ponen en marcha el proceso denominado «inflamación», que es uno de los efectos característicos de la activación de la inmunidad innata, de forma que en aquellos lugares donde se produce esta reacción inmunitaria notaremos hinchazón, enrojecimiento, calor y dolor. Además, acabarán también participando células de mayor nivel y se reparará el tejido infectado.
La tercera línea: la inmunidad adaptativa
Si esta inmunidad innata es suficiente para contener la infección, la respuesta de defensa finaliza. Pero normalmente no basta con estas defensas y tienen que entrar en juego las «unidades» más especializadas, que constituyen la inmunidad adaptativa o específica: «Esta respuesta tiene un nivel de complejidad muy alto y solo está presente en vertebrados, alcanzando en los mamíferos el máximo nivel de desarrollo», ha explicado Alfredo Corell. En general, esta respuesta tarda más en adaptarse que la innata, pero es eficaz allá donde la primera falla.
Los representantes más importantes de este nivel son los linfocitos B y T: los T se llaman así porque se diferencian en el timo y los B porque se descubrieron en la bursa de los pájaros. En el ser humano, sin embargo, estas células se diferencian dentro de los huesos, en la médula ósea. Tanto los linfocitos B como los T se caracterizan por una peculiaridad: «En su superficie hay moléculas que reconocen a agentes infecciosos de forma muy específica, comparable al acoplamiento de una llave en una cerradura: su conexión es muy, muy exacta», ha comentado el Catedrático.
Un ejército de clones de linfocitos B y T
¿Cómo tienen esa capacidad de reconocer con tanta precisión al patógeno? En este punto se puede comprobar lo sofisticada y despiadada que ha sido durante millones de años la guerra entre los patógenos y el sistema inmunitario: si los virus son maestros en replicarse y mutar, introduciendo pequeños cambios o errores en su material genético, el sistema inmunitario no se queda atrás en su capacidad de cambiar: tiene un ejército de billones de clones especializados cada uno contra un pedazo de cada posible microbio patógeno.
«Estas células —los linfocitos B y T— tienen unos receptores con un sistema genético único que combina fragmentos de genes al azar», ha comentado Alfredo Corell. «El mecanismo es similar al de una lotería, con cinco bombos, donde los genes se organizan en bloques y se combinan al azar».
Con la combinación al azar entre los «bombos» basta para conseguir «millones de variantes que reconocerán a millones de moléculas —como las que pueden estar en la superficie de los patógenos—», ha proseguido el Catedrático. Además, la maquinaria enzimática de estas células introduce modificaciones durante su fabricación genética, lo que multiplica las variaciones a nivel de millones. Cuando estas moléculas de hongos, bacterias, virus son reconocidas por el sistema inmunitario de forma específica se las conoce como antígenos.
Entre los linfocitos T hay dos grandes tipos de células: «Por una parte están las cooperadores (o linfocitos T CD4), que trabajan como directores de orquesta, "tomando" las decisiones de la inmunidad adaptativa y decidiendo la respuesta», ha explicado Corell. Aparte de éstas cooperadoras, están las T citotóxicas (CD8), que asesinan a células infectadas o tumorales.
¿Cómo matan a estas células? «Producen dos tipos de sustancias: una crea un poro, que agujerea la célula —infectada o tumoral—, a través del que inyectan enzimas que inducen el suicidio celular — apoptosis—», ha explicado el profesor. «El otro mecanismo depende de una estructura de su membrana —en su exterior— que también induce el suicidio de la célula infectada o tumoral. Estos dos son mecanismos alternativos y complementarios».
Anticuerpos: los misiles dirigidos
Por otra parte, están los linfocitos B: «Su función fundamental es la síntesis de los anticuerpos o inmunoglobulinas», que ocurre bajo «indicación» de los directores de orquesta, las células T CD4: Éstas producen distintas citocinas, unas moléculas pequeñas y solubles que «trabajan» como mensajeras y que trasladan órdenes del tipo «asesinato», de producción de anticuerpos, de aumentar la inflamación, etc.
A su vez, los anticuerpos son grandes proteínas, que reconocen al antígeno de forma específica, para señalizárselo a otras células, aunque en algunas ocasiones son capaces de neutralizar por completo al patógeno: «Los anticuerpos son verdaderos misiles, con un grado de especificidad máxima», ha comentado Corell. Son además, armas muy versátiles y ponen en marcha mecanismos alternativos y complementarios para la muerte del agresor.
La importancia de la memoria
Una vez que se elimina la infección, la mayoría de las células B y T declinan y mueren, pero una pequeña fracción sigue circulando por la sangre, en forma de células de memoria, como si fueran veteranos de guerra que no han olvidado a su enemigo. Lo mejor es que están listas para volver a reconocerlo y desencadenar la respuesta adaptativa, capaz de tener éxito allá donde la innata es insuficiente, y con mayor rapidez y eficacia que en la primera batalla.
Precisamente aprovechando esto, la vacunación consiste en estimular con un agente inofensivo la respuesta adaptativa para que se generen anticuerpos y células de memoria que estén listos para actuar cuando llegue el patógeno real.
En el caso del SARS-CoV-2 se ha observado que los anticuerpos desaparecen algunos meses después de la infección. «Eso no significa que estas personas dejen de tener inmunidad», ha explicado Alfredo Corell. «Aparte de los anticuerpos, pueden quedar células de memoria, capaces de disparar la respuesta si ocurre una reinfección».
De hecho, en el caso del coronavirus se han detectado linfocitos T CD4 y CD8 de memoria tras una primera infección. También se han encontrado células de este tipo aparentemente capaces de responder ante el SARS-CoV-2 y producidas en respuesta a otros coronavirus causantes de catarros (este efecto es lo que se denomina inmunidad cruzada).
Microfotografía electrónica de transmisión de partículas de SARS-CoV-2 (en naranja), aisladas de un paciente, y obtenida en el IRF, en Fort Detrick, Maryland (EE.UU.) - NIAID
«Es muy difícil saber cuánto dura la inmunidad frente al SARS-CoV-2», ha resumido el Catedrático. La pandemia apenas tiene unos cuantos meses de edad y en muchos asuntos solo hay disponibles estudios preliminares. Por el momento, sin embargo, parece que los anticuerpos duran al menos cuatro meses. Sin embargo, en el caso de otros patógenos la inmunidad puede durar meses, años o toda la vida.
Los sistemas de alerta
Una vez que se conocen los niveles básicos de este ejército que es el sistema inmunitario hay que tener en cuenta cómo se comunican entre sí. Uno de los puntos más críticos es la conexión entre la segunda y la tercera líneas de defensa, es decir, entre la inmunidad innata y la adaptativa.
«Hay muchas células actuando como intermediarias: por ejemplo, los linfocitos T necesitan que otras células "cotillas" les muestren al antígeno —la molécula del patógeno reconocida por el sistema inmunitario—», ha explicado Corell. «Cualquier célula puede ser presentadora de antígeno, pero además hay células profesionales en hacerlo: se trata de las células dendríticas, los macrófagos o los linfocitos B».
Esta presentación del antígeno no ocurre en cualquier parte del organismo: solo ocurre en el bazo, en los ganglios linfáticos y en las mucosas, en el nivel cero del sistema inmunitario. De ahí que, a la hora de elaborar una vacuna frente al coronavirus, sea un punto a favor que el medicamento ponga en marcha la respuesta inmunitaria en las mucosas respiratorias, que son la puerta de entrada principal del virus.
¿Quién vigila al vigilante?
Por último, dado que en el sistema inmunitario hay células capaces de agujerear a otras, de fagocitar o de lanzar «armas químicas», no sorprende que sea muy importante regular su actividad y su poder destructivo. «El sistema inmunitario está fuertemente regulado», ha explicado Alfredo Corell». «Si su respuesta se sostiene en el tiempo puede llegar a ser dañina».
Aparte de eso, la COVID-19 genera a veces graves síntomas por una activación excesiva de la inflamación: «Se inicia una cascada o tormenta de citocinas, se desregulan las señales y se produce una respuesta hiperinflamatoria», ha comentado Corell.
¿Cómo se lleva a cabo esta regulación? Intervienen multitud de células y moléculas, entre las que también hay interacciones con el sistema nervioso y el sistema endocrino. Por eso, cuestiones tan dispares como el sexo, el deporte, las horas de sueño, la alimentación o los niveles de estrés/ansiedad pueden influir sobre el nivel de activación del sistema inmunitario, a través de mensajeros (hormonas, neurotransmisores, citocinas) como las endorfinas o el cortisol.
Finalmente, de la salud inmunitaria dependerá nuestra capacidad de responder a agresiones, como las infecciones, y salir airoso, o, en vez de eso, enfermar.
abc
Etiquetas:

















-1747892762.jpg&h=190&w=280&zc=1&q=100)




-1747847225.jpg&h=190&w=280&zc=1&q=100)















-1747835090.jpg&h=120&w=187&zc=1&q=70')




